科研动态




疼痛,是癌症、神经痛和关节炎等疾病患者中最常见且令人恐惧的临床症状。疼痛发生的根本机制在于,疾病在发展过程中可产生伤害性刺激因子,并可持续激活外周神经的膜受体蛋白(如TRPV1),引发以离子电流为基础的疼痛信号,继而通过神经传导传递至大脑,产生持续且强烈的痛觉。目前,临床上广泛使用的阿片类镇痛药(如吗啡、杜冷丁等),是通过抑制中枢神经系统中大脑皮层的痛觉区达到镇痛目的,而并非从致痛根源上阻断疼痛信号,易引起神经环路的可塑性变化,存在可控性、易脱靶、药物耐受、强成瘾性以及镇痛时间短等缺点。因此,从疼痛机制的根本出发,亟需开发不耐药、无成瘾且具超长效镇痛的新策略和技术,具有重要的科学意义和临床价值。
近日,复旦大学材料科学系/聚合物分子工程国家重点实验室步文博教授与合作团队,先后在Angewandte Chemie International Edition和Advanced Materials期刊上,连续报道了两类基于生物物理作用的新型电活性纳米功能材料,分别通过干预神经元细胞膜的离子电流和膜受体蛋白空间分布,成功实现了对顽固性疼痛的长时、高强度、非成瘾的高效缓解。从疼痛机制的角度出发,该系列研究开发的不耐药、非成瘾且具超长效镇痛的新策略和技术,不仅从致痛根源上阻断疼痛信号传导达到镇痛目的,也为基于动作电位和膜受体蛋白的疾病治疗及新型药物研发提供全新的思路。
首先,研究人员提出了一类离子电整流镇痛新机制,用于指导非阿片类高效镇痛药研发(图1)。通过构建MgB2纳米材料,利用其在生理条件下的水解反应,原位动态生成了具有类硼烯结构的二维BH纳米片,利用BH离域π电子与钠、钾阳离子间的相互作用,可精准调节神经周围离子的分布和跨膜扩散,改变膜离子通道的电导率,从而显著提高神经动作电位的阈值,抑制神经兴奋性,由此实现了高效镇痛。体外背根神经元(DRG)与材料MgB2孵育后显示,其阈值电位从正常的-35.9 mV显著增加到-5.9 mV,表明动作电位的发放变得更加困难,从而有效地抑制神经元兴奋性,阻断疼痛上行传导至中枢,从而短时内发挥出强效镇痛作用。在小鼠疼痛模型中,研究人员构建了炎性痛(CFA)、化疗痛(CINP)及坐骨神经结扎导致的神经病理性痛(CCI)三种疼痛模型。三种疼痛模型的实验结果显示,鞘内注射MgB2的镇痛效果比MgSO4分别高约2.23、3.20和2.0倍,比吗啡分别高约1.04、1.66和1.95倍。特别值得关注的是,在炎性痛模型中,多次注射MgB2可持续发挥长达84小时的镇痛作用,且不会导致药物耐受;相比之下,吗啡治疗24小时后即出现明显的药物耐受(图2)。这类MgB2纳米材料不但具有强效镇痛作用,且重复多次给药不会诱发耐受或成瘾等副作用;同时材料起效后完全分解为可被组织代谢和吸收的离子及小分子,具有良好的生物安全性,是一类极具临床转化潜力的非阿片类新型镇痛药。该研究创新性地提出了一类离子电整流镇痛新机制,通过设计电活性材料与钠、钾阳离子相互作用,改变离子分布与扩散状态,影响神经电生理信号的形成与传导,实现了对神经行为的有效调节,有望克服成瘾和耐药等临床瓶颈问题,指导基于离子电流调控的非阿片类高效镇痛药物的研发。该研究已发表于Angew. Chem. Int. Ed. 2024, 63, e202405131.
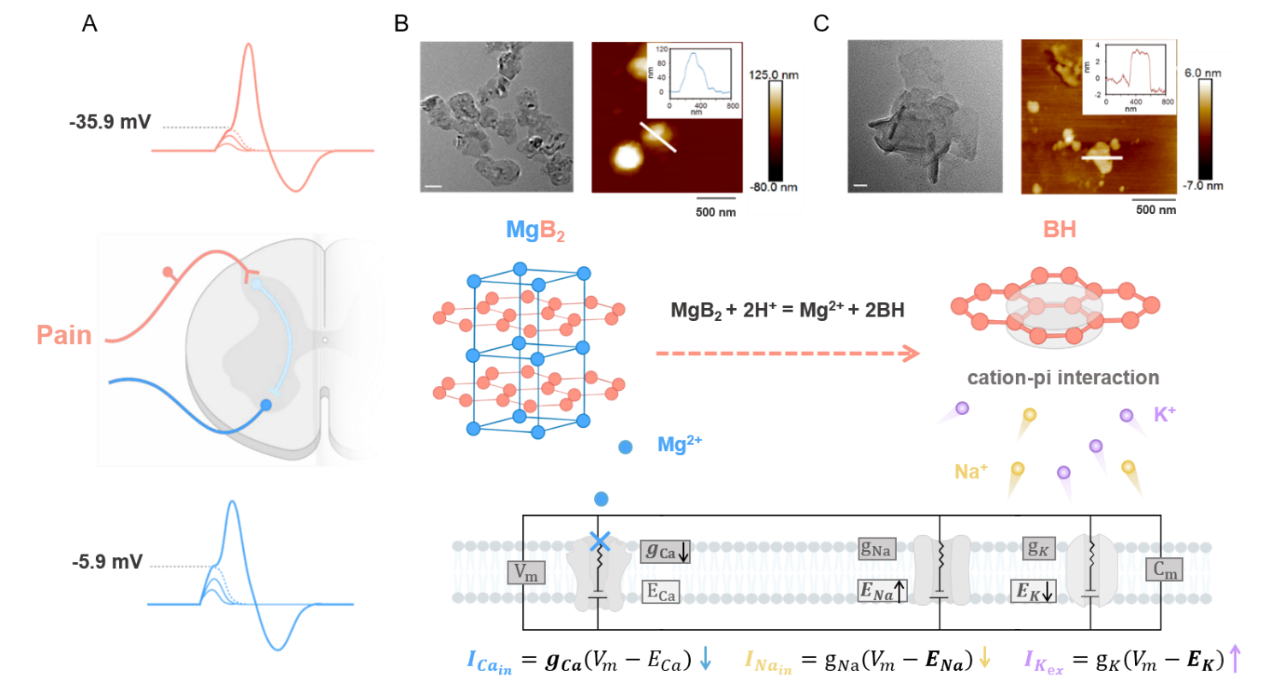
图1. MgB2离子电整流作用:显著提高动作电位发放阈值,抑制神经兴奋活动。
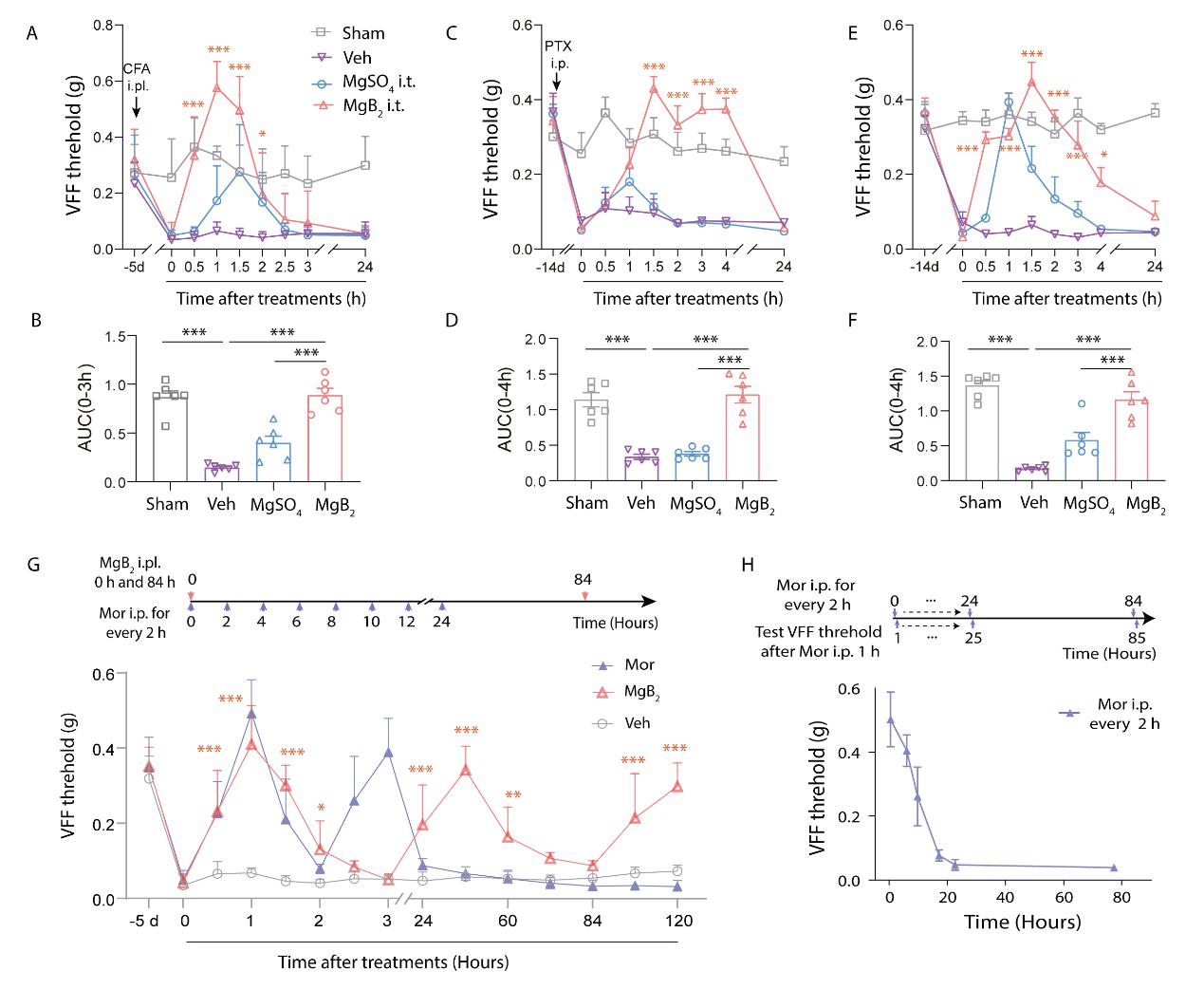
图2. 机械痛敏检测:MgB2可对多种疼痛模型强效止痛,效果优于吗啡,且无耐药性。
其次,受启发于膜受体蛋白的脂筏学说,研究人员首次开发了一类利用超声介导纳米压电极化场,调控膜受体蛋白空间分布(内化)的革新技术。巧妙利用膜蛋白受疏水力和静电力相互作用而“漂浮”于膜表面的力平衡稳态特征,通过超声波介导纳米压电材料产生的压电极化场,与带电蛋白发生电荷互作,打破膜受体蛋白漂浮于膜表面的力平衡稳态,继而调控神经细胞表面痛觉相关受体蛋白TRPV1的内化,创新性地从骨肿瘤致痛根源上切断骨癌痛的产生和传导,实现了基于外周神经的强效非成瘾镇痛效果(图3)。该工作构建了具有良好压电响应性能的BiOIO3纳米片(BIONSs),经局部注射后可贴附在神经细胞表面。在0.08 W/cm2的安全超声功率下,BIONSs可产生15.29 μV的极化场。细胞实验结果首次发现,材料的压电极化作用类似于中医的针刺反应(针灸),当材料在5 min超声极化场作用下,可调控细胞膜表面TRPV1的空间分布,使其内化进入细胞质内、并进一步发生降解,由此导致脊髓神经元内Ca2+信号减少,抑制宽范围动态神经元的活性(图4),从根源上阻止了癌性骨痛(CIBP)的传递。更为重要的是,这类超声极化场“针灸”镇痛新策略,被验证可在多种小鼠疼痛模型中展现出优异的TRPV1抑制效率和疼痛抑制效果, 有效镇痛时长高达6小时,是临床吗啡的3倍,且未发现有成瘾性。该研究开发的基于超声介导纳米压电极化场的调控膜受体蛋白空间分布(内化)的革新技术,首次发现了局域微电场作用可调控膜受体蛋白内化的新现象,提出了基于生物物理效应的膜蛋白调控新方法和新机制,不但开辟了从根源抑制疼痛传导的新思路,也为细胞间通讯调控提供了全新视野。该研究已在线发表于Advanced Materials, DOI: 10.1002/adma.202403979.
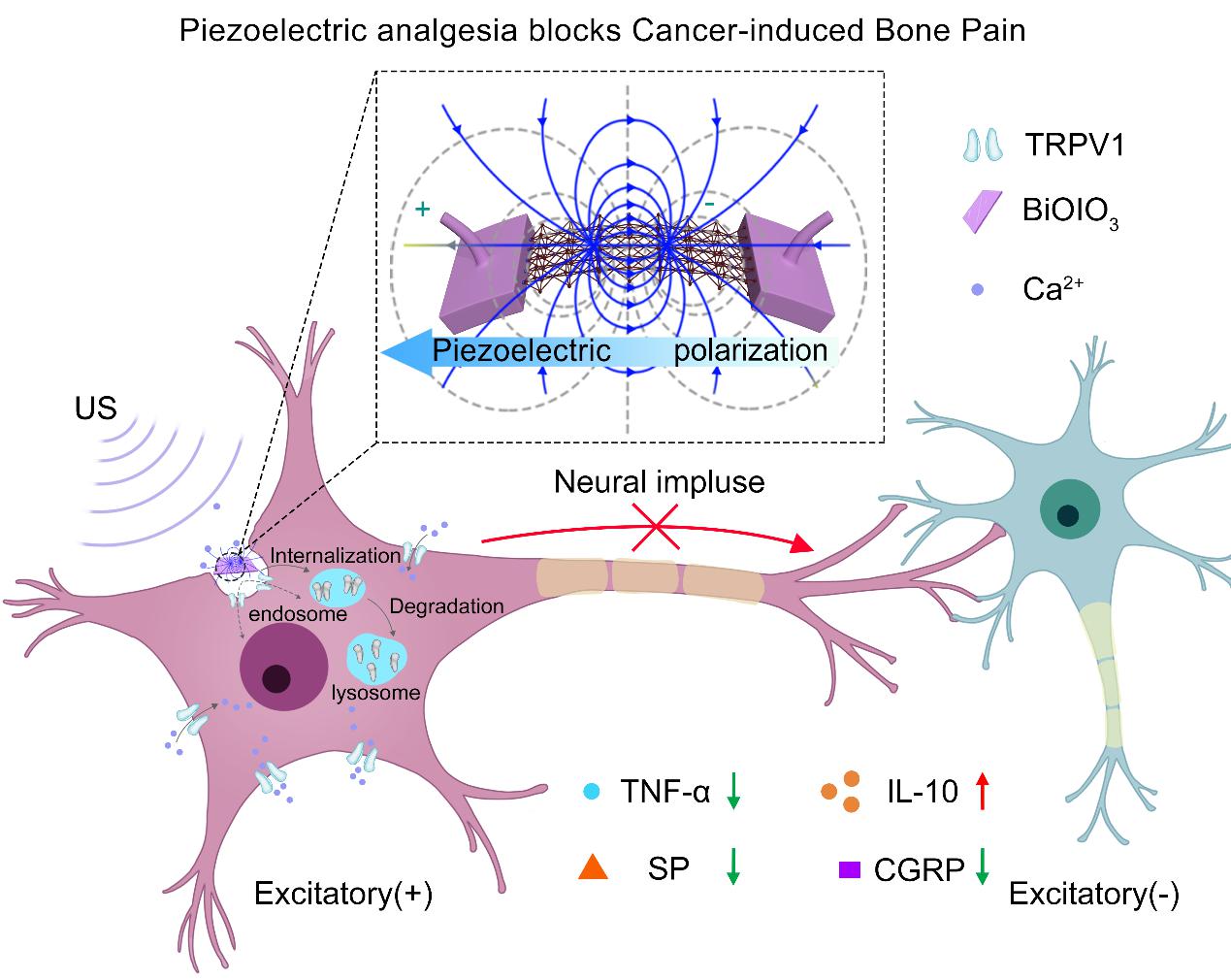
图3. 超声激活的压电极化场诱导TRPV1内化,从根本上抑制疼痛信号传导。

图4. 超声介导的压电极化场诱导TRPV1内化,降低基于Ca离子流的痛觉信号转导。
上述系列研究为解决临床疼痛治疗失效快、易成瘾和易耐受的瓶颈问题,提供了一类全新的纳米医学解决方案。更为重要的是,该类多学科交叉研究还有望启示基于电活性材料、纳米压电材料与生物信息离子流和带电生物大分子物理相互作用的空间分布、结构、聚集调控,促进生物物理、蛋白质生物学、临床医学和纳米医学等多学科深度交叉融合,为解决生命健康领域的重大科学问题提供一类基于纳米电活性材料的可借鉴革新技术。
论文信息:
题目:Ion Current Rectification Activity Induced by Boron Hydride Nanosheets to Enhance Magnesium Analgesia
作者:Yanyan Liu, † Qi Qi, † Yaqin Jiang, † Peiran Zhao, † Lijie Chen, Xiaqing Ma, Yuhan Shi, Jianxun Xu, Jinjin Li, Feixiang Chen, Jian Chen, Le Zhang, Yelin Wu, Xingwu Jiang, Dayong Jin,* Tao Xu,* Wenbo Bu*
期刊:Angew. Chem. Int. Ed. 2024, 63, e202405131.
论文链接 https://onlinelibrary.wiley.com/doi/10.1002/anie.202405131
题目:Piezoelectric Analgesia Blocks Cancer-Induced Bone Pain
作者:Yifei Yin, † Peiran Zhao, † Xianyun Xu, † Bangguo Zhou, Jian Chen, Xingwu Jiang, Yanyan Liu, Yelin Wu, Wenwen Yue,* Huixiong Xu,* Wenbo Bu*.
期刊:Advanced Materials, DOI: 10.1002/adma.202403979.
论文链接 https://onlinelibrary.wiley.com/doi/10.1002/adma.202403979