科研动态




细胞器之间的时空动态通讯在维持癌细胞的快速增殖、耐药性和高度侵袭性等恶性生物学特征中起至关重要的作用。研究表明,溶酶体与内质网间的通讯对肿瘤耐药非常关键;当癌细胞经药物处理后受到内质网应激的威胁时,可利用细胞器间的通讯功能启动溶酶体相关自噬程序,通过降解累积的毒性蛋白和清除受损内质网,促使癌细胞恢复至稳态,从而抑制了内质网应激相关凋亡程序。因此,针对癌细胞器间通讯的时空性特征,设计新型药物以时空序惯性的方式阻断癌细胞器间关键信号通讯,是一类极具应用前景的肿瘤治疗新策略。
近日,复旦大学材料科学系/聚合物分子工程国家重点实验室步文博教授与复旦大学基础医学院吴健教授、复旦大学附属华山医院姚振威教授的合作团队,在国际核心学术期刊Advanced Materials 上发表研究论文,首次提出了细胞器时空通讯拦截的创新策略用于肿瘤化学动力学疗法(Chemodynamic Therapy,CDT),揭示了其治疗肿瘤的生物学新机制。研究人员设计合成了一种由高活性非晶Fe内核和化学稳定性晶化Fe3O4外壳层构成的Fe@Fe3O4纳米颗粒作为纳迷拦 截 器(ACFeNPs)。ACFeNPs的特殊核壳结构赋予其具备持续高效催化非均相Fenton反应的特性,产生的羟基自由基(•OH)及其作用位点与材料在细胞内的时空转运特性和轨迹精准吻合。ACFeNPs被癌细胞内吞后,首先进入酸性溶酶体腔室并催化过氧化氢(H2O2)产生羟基自由基,通过激活AMPK/mTOR信号通路而启动自噬系统;随后,羟基自由基利用其强氧化性损伤溶酶体,诱导肿瘤细胞内功能失调性自噬溶酶体的形成,进而阻断了自噬流;而逃逸出溶酶体的ACFeNPs可靶向内质网,通过催化生成羟基自由基,进而诱导内质网应激,由于溶酶体自噬流的预先阻断,导致大量积累有毒蛋白和受损内质网无法得到及时清除和修复,最终高效激活内质网应激相关IRE1/JNK凋亡信号通路诱导癌细胞死亡。该研究利用纳米材料在癌细胞内的时空转运特性,通过时空序惯性的方式高效阻断了溶酶体与内质网之间的通讯,从而在癌细胞和荷瘤鼠活体上实现了高效的肿瘤CDT治疗。
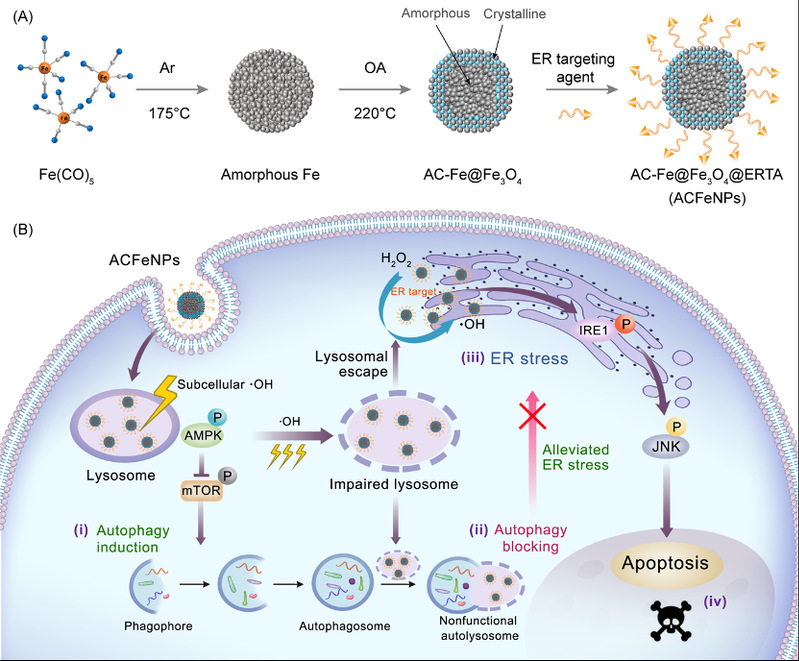
该研究提出的细胞器时空通讯拦截新策略和揭示的相关肿瘤治疗生物学机制,展现了纳米药物在干扰细胞器时空通讯领域具备的独特生物学优势,不但为纳米材料应用于肿瘤治疗领域开辟了新方向,同时也为利用细胞器通讯拦截策略用于神经调控、免疫、代谢类疾病等领域提供了借鉴性研究思路。这一成果得到了编辑和审稿专家的一致认可,并被推荐发表于Advanced Materials 上。复旦大学材料科学系博士后李慧妍和复旦大学附属华山医院博士后张会林、南京师范大学硕士生何晓芳为共同第一作者,复旦大学材料科学系/聚合物分子工程国家重点实验室步文博教授,复旦大学基础医学院吴健教授和复旦大学附属华山医院姚振威教授为共同通讯作者。该工作得到国家自然科学基金重点项目、上海市教委创新重大基础项目、国家重点研发计划和博士后创新人才支持计划等项目经费支持。
具体论文信息如下:
Huiyan Li#, Huilin Zhang#, Xiaofang He#, Peiran Zhao, Tong Wu, Jinxuan Xiahou, Yelin Wu, Yanyan Liu, Yang Chen, Xingwu Jiang, Guanglei Lv, Zhenwei Yao*, Jian Wu*, Wenbo Bu*. Blocking Spatiotemporal Crosstalk between Subcellular Organelles for Enhancing Anticancer Therapy with Nanointercepter.
Advanced Materials. 2023 doi: 10.1002/adma.202211597.