科研动态




癌细胞相关转录因子的过度激活,是肿瘤组织的一类普适性生物学特征,也是肿瘤难治愈、易复发和侵袭转移的根本原因之一。然而,传统观点认为转录因子是一类不可成药靶点,原因在于转录因子普遍缺乏结合口袋空间,且与DNA结合界面具有动态变化的特征,严重阻碍了经典共价抑制剂的研发。因此,迫切需要发展非空间结构依赖的新型化学体系,从特征生化基团的独特角度干预转录因子功能,有望开发一类基于转录因子抑制的抗肿瘤新疗法,并启发非共价分子药物研发新思路。
近日,复旦大学材料科学系/聚合物分子工程国家重点实验室步文博教授、澳大利亚悉尼科技大学/宁波东方理工大学(筹)金大勇院士和复旦大学附属肿瘤医院何新红主任医师的合作团队,受启发于高分子化学经典的封端反应,首次提出了自由基封端转录因子的抗肿瘤新策略,巧妙利用逆向思维,通过自由基生化反应封闭转录因子活性位点,创新性实现了肿瘤细胞内转录因子NF-κB的高效抑制(图1)。该工作构建了装载碳自由基前体分子(AIPH)的热敏纳米胶束,经癌细胞内吞和低热处理(43°C)后,可快速在癌细胞内解组装并释放AIPH,通过持续热分解生成碳自由基(R∙),完成癌细胞内R∙精准递送。该研究创新性揭示了碳自由基的生化反应新机制:R∙可以通过自由基亲电加成反应与核酸碱基的双键结合,还可以通过自由基链式反应与NF-κB中的巯基结合形成C-S键(图2)。通过封端这两个关键位点,可同时抑制NF-κB核转位和NF-κB-DNA结合,NF-κB转录总抑制率高达94.1%(图3)。
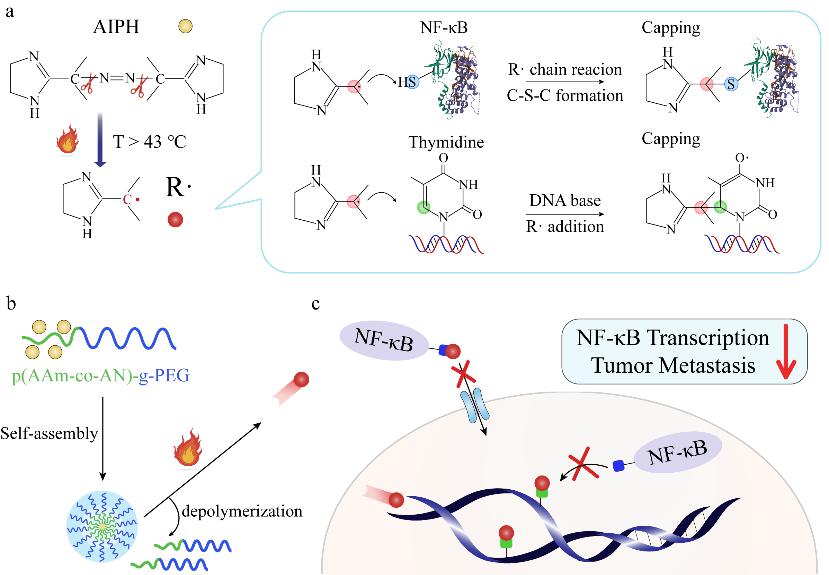
图1. R∙介导癌细胞内NF-κB和DNA封端,高效抑制 NF-κB转录和肿瘤转移。
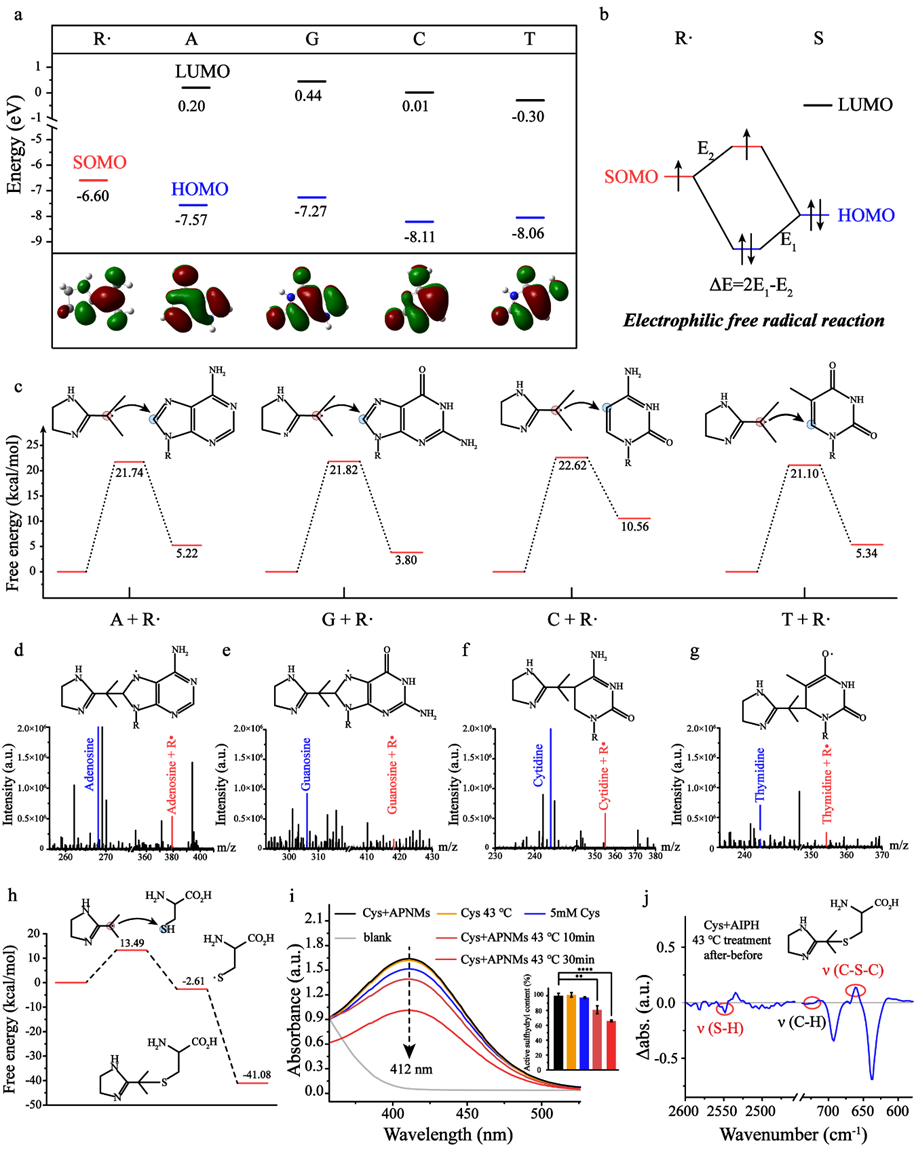
图2. R∙通过亲电自由基加成与DNA碱基中的双键结合;R∙通过两步自由基链式反应与NF-κB活性巯基结合形成C-S-C键。
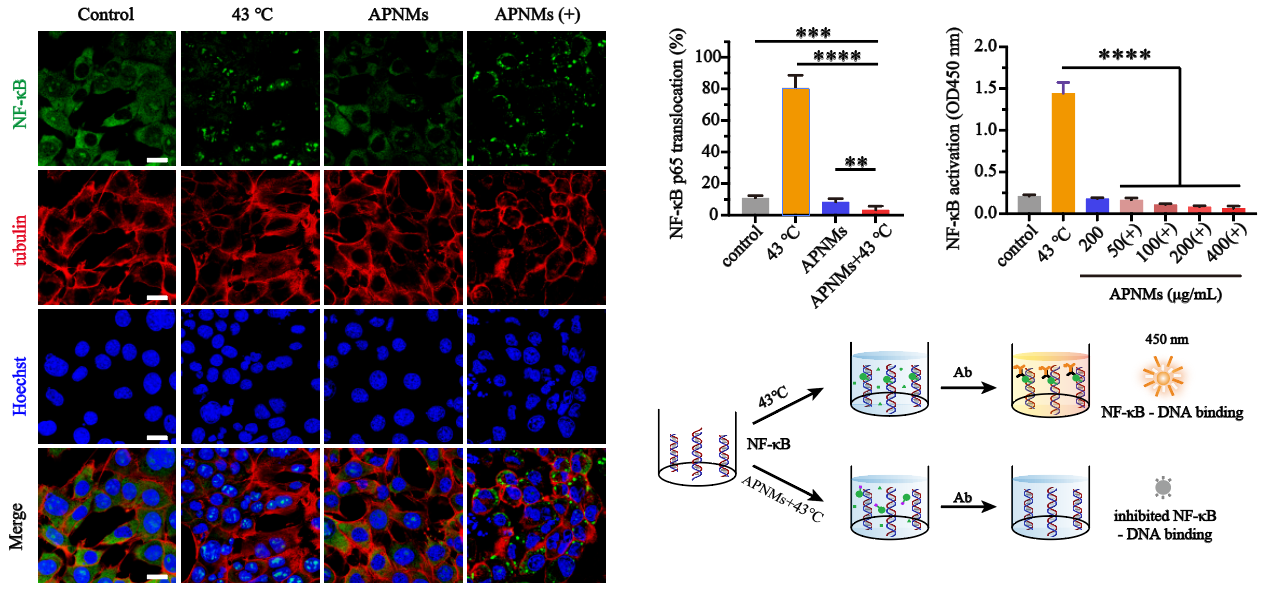
图3. R∙封端新策略同时抑制NF-κB核转位和NF-κB-DNA结合。
更为重要的是,在室温和正常体温(37°C)下,该研究合成的纳米胶束具有良好的稳定性和生物安全性,通过与临床肿瘤局域热疗技术(射频消融疗法)结合,碳自由基封端策略在移植瘤实验鼠中展现出优异的NF-κB抑制效率,显著抑制了肿瘤治疗后的损伤修复和肿瘤转移,为解决临床射频消融疗法的热沉效应瓶颈问题提供了一类全新的纳米医学方案。
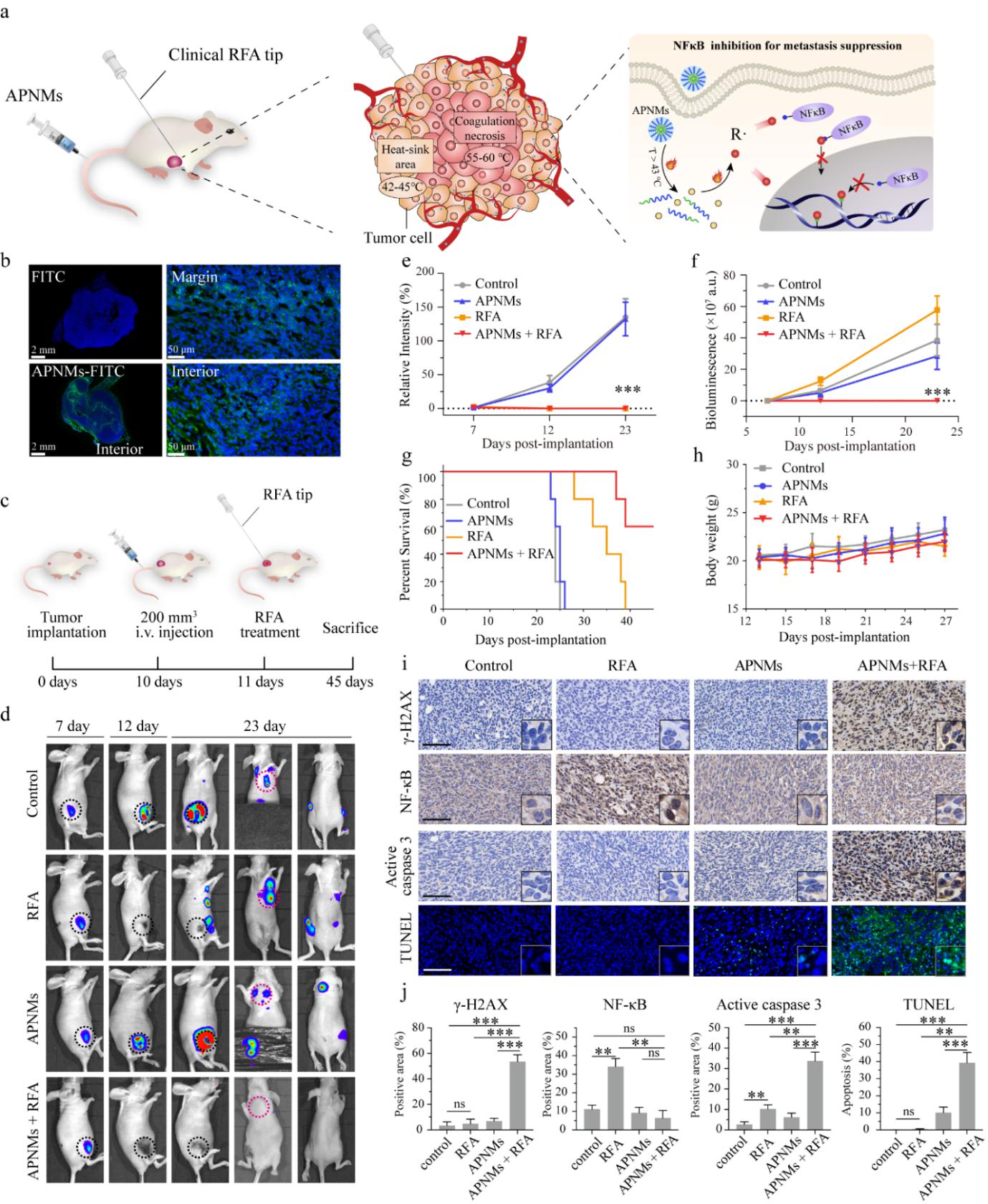
图4. R∙封端策略介导的NF-κB抑制可显著抑制射频消融术后的肿瘤转移。
该研究提出的自由基封端转录因子抗肿瘤新策略,揭示了碳自由基与细胞内生物大分子(DNA和NF-κB)的生化反应新机制,不但开辟了构建转录因子自由基抑制剂的新思路,也为非氧自由基的肿瘤治疗机制研究提供了新途径。值得一提的是,该交叉研究还有望启示自由基反应介导的生物大分子可控修饰,促进化学生物学、自由基化学、临床医学和纳米医学等多学科深度交叉融合,为解决生命健康领域的重大科学问题提供了一类基于自由基化学的可借鉴新技术。
该工作已在线发表于《Angewandte Chemie International Edition》期刊,复旦大学材料科学系博士后赵沛然、李慧妍为论文共同第一作者;复旦大学材料科学系/聚合物分子工程国家重点实验室步文博教授、澳大利亚悉尼科技大学/宁波东方理工大学(筹)金大勇院士、复旦大学附属肿瘤医院何新红主任医师为论文共同通讯作者。该工作得到了国家自然科学基金重点项目、上海市教委创新重大基础项目等经费支持。
论文信息:
题目:Carbon Free Radical (R∙) Inactivates NF‐κB for Radical Capping Therapy
作者:Peiran Zhao,Huiyan Li, Bingxia Sun, Chaochao Wang, Guanglei Lv, Chao Chen, Leilei Ying, Xinhong He*, Dayong Jin*,and Wenbo Bu*.
期刊:Angewandte Chemie International Edition, 2024, DOI: 10.1002/anie.202405913.
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202405913